Le VIH et ses sanctuaires : des anticorps capables d’éliminer les cellules infectées
 lundi 25 avril 2016
lundi 25 avril 2016 
Faisant suite à nos deux articles Les sanctuaires du VIH apparaissent peu à peu et Le VIH et ses sanctuaires : vision dynamique sur les sanctuaires du VIH-1, voici un article plus positif pour nos esprits qui montrent les travaux de l’INSERM sur l’élimination et dans quel contexte. Nous nous sommes plongés dans les communications scientifiques de l’Institut Pasteur et de l’INSERM. Une première partie reprend le communiqué de presse de l’Institut pasteur, puis nous reprenons l’article avec, en premier, son introduction suivis par les résultats.
Ces résultats sont publiés dans Nature communications le 3 mars 2016.
Voir en ligne : http://www.nature.com/ncomms/2016/1...
Communiqué de presse de l’Institut Pasteur Paris - 3 mars 2016
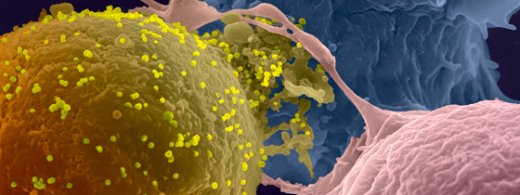
Le sida est une maladie infectieuse causée par le virus de l’immunodéficience humaine (VIH). On estime que 1,2 millions de personnes sont décédées du sida l’année dernière et que près de 35 millions sont aujourd’hui infectées par le virus, plaçant le sida en tête des maladies infectieuses les plus meurtrières au monde (OMS, 2015). Pour combattre cette maladie, des traitements antirétroviraux existent mais, faute de moyens, seulement 16 millions de personnes y ont accès en 2015. De plus, le virus n’est pas complètement éliminé par ces traitements : il peut se multiplier à bas bruit et constituer ce qu’on appelle un réservoir viral. En cas d’interruption du traitement anti rétroviral, ce réservoir peut être la source d’une nouvelle multiplication virale dans l’organisme, même après de nombreuses années de thérapie. Il est donc important de mieux comprendre les mécanismes qui régulent la formation de ce réservoir et de déterminer des stratégies pour l’éliminer.
Chez certains patients infectés, des anticorps particuliers ont été identifiés pour leur capacité à bloquer la réplication de très nombreuses souches de VIH-1. En étudiant le mécanisme d’action de ces anticorps dits « neutralisants à large spectre » (bNAbs), les chercheurs de l’équipe d’Olivier Schwartz de l’unité « Virus et immunité » (Institut Pasteur / CNRS), cofinancée par le Vaccine Research Institute (VRI, ANRS/Inserm) et du groupe « Réponse humorale aux pathogènes » (Institut Pasteur / CNRS), dirigé par Hugo Mouquet, en collaboration avec l’équipe d’Olivier Lambotte (Hôpital Bicêtre), ont démontré qu’ils agissent de façons complémentaires. Tout d’abord, les bNAbs neutralisent la propagation du virus, et notamment son passage de cellule à cellule. Mais ils sont également capables, pour les plus efficaces d’entre eux, de reconnaître directement les cellules infectées et d’entraîner leur destruction par les cellules Natural Killer (NK), cellules du système immunitaire chargées d’éliminer les cellules anormales de l’organisme. Pour cela, les bNAbs peuvent reconnaître différentes parties de l’enveloppe virale exposées à la surface des cellules humaines. Les scientifiques ont observé que l’exposition de ces différentes parties de l’enveloppe est très variable à la surface des cellules infectées, et dépend de la souche de VIH, modulant donc la réponse des cellules immunitaires. Ils ont observé que la combinaison de différents bNAbs permet d’augmenter leur efficacité pour recruter des cellules NK. Enfin, les chercheurs ont montré que les cellules provenant du réservoir viral de patients sont également reconnues par les bNAbs, à des niveaux généralement suffisants pour entrainer leur élimination.
« Ce travail représente une étape importante dans la compréhension du mécanisme d’action des anticorps neutralisants à large spectre. Il définit les paramètres contrôlant les capacités de ces anticorps à recruter des cellules immunitaires et conforte l’idée qu’ils pourraient réduire le réservoir chez les patients infectés par le VIH », explique Olivier Schwartz.
La caractérisation de ces anticorps bNAbs est importante pour différentes raisons. La façon dont ils reconnaissent l’enveloppe virale donne en effet des informations précieuses pour la conception de candidats vaccins. De plus, il a déjà été démontré que les bNAbs peuvent être utilisés chez l’homme. Les plus efficaces sont actuellement en cours d’essai clinique aux Etats-Unis pour leur faculté à abaisser significativement la charge virale pendant 28 jours. Ces immunothérapies représentent donc de nouvelles stratégies thérapeutiques ou préventives prometteuses.
Ces travaux ont été financés par l’ANRS, le LabEx Vaccine Research Institute (ANR-10-LABX-77), Sidaction, la Fondation Areva, le LabEx IBEID, le LabEx Milieu Intérieur, le 7e programme cadre européen, et l’European Research Council (ERC).
Ce communiqué de presse est issue d’une publication dans "Nature-communication de la même date.
Nous vous en avons fait une traduction limitée à l’introduction et l’analyse des résultats. La partie Méthodologie étant très orientée biologie nécessite des connaissances et beaucoup de temps pour la rendre digeste, afin que toute l’information soit complète sur un sujet hautement sensible.
Auteurs :
Timothée Bruel, Florence Guivel-Benhassine, Sonia Amraoui, Marine Malbec, Léa Richard, Katia Bourdic, Daniel Aaron Donahue, Valérie Lorin, Nicoletta Casartelli, Nicolas Noël, Olivier Lambotte, Hugo Mouquet & Olivier Schwartz
La région Fc du VIH 1 spécifique à l’ENV des anticorps largement neutralisants (bNAbs) sont indispensables pour supprimer les virus, malheureusement par les mécanismes qui restent mal compris. Ici, nous identifions les bNAbs qui exercent une action de type cytotoxicity cellulaire dépendant d’anticorps (ADCC) dans la culture cellulaire et tue des lymphocytes HIV-1 infectéés par le tueur naturel (NK).
Ces anticorps ciblent les sites de CD4 liant, les boucles de glycanes / V3 et V1 / V2 sur les gp120, ou le fragment gp41.
Le paysage résultant de l’exposition d’épitopes de l’ENV à la surface et la sensibilité des cellules infectées par l’ADCC varient considérablement entre les souches virales. Les ADCC efficaces nécessitent une surface cellulaire soutenant la liaison des bNAbs à ENV, et la combinaison des bNAbs permet une activité de destruction puissante.
En outre, les cellules infectées réactivés, des personnes séropositives, présentent des modèles d’épitope hétérogènes d’ENV, avec des niveaux qui sont souvent, mais pas toujours, suffisants pour déclencher la destruction par les bNAbs. Notre étude définit les paramètres contrôlant l’activité de l’ADCC des bNAbs et prend en charge l’utilisation d’anticorps les plus puissants pour effacer le sanctuaire viral.
Introduction
Deux à quatre ans après l’infection, les rares patients positifs au VIH-1 développent une activité neutralisante largement sérologique contre diverses souches virales [1], [2], [3].
L’isolement et la caractérisation moléculaire des bNAbs produites dans ces individus ont permis l’identification de cinq grands « sites de vulnérabilité » sur le VIH trimer ENV [2], [4], [5].
Le transfert passif des bNAbs plus puissants fournit à la fois une pré-exposition prophylactique et des modèles de traitements sur les macaques et des modèles de souris humanisées [3], [4], [5]. Chez les personnes infectées par le VIH-1, une perfusion unique d’3BNC117 bNAb, qui cible le site de CD4 de liaison sur gp120, diminue la virémie jusqu’à 28 jours [6].
In vivo, l’activité antivirale des bNAbs sont le résultat des interactions des sites de liaison ENV avec l’antigène qui bloque l’entrée des virions exempts de cellules ainsi que la transmission de cellule à cellule virale [7], [8]. Leur activité est également très dépendante des fonctions effectrices à médiation par la région Fc, comme démontré chez l’animal à l’aide de bNAbs Fc-mutés [9], [10], [11].
Des fonctions effectives d’anticorps comprennent la cytotoxicité cellulaire dépendante des anticorps (ADCC), intermédié par la liaison de la partie Fc des anticorps aux récepteurs Fc (TCR) sur les cellules d’effecteur (cellules qui met en activité les mécanismes immunitaires
NDLR), y compris les cellules tueuses naturelles (NK) [12], [13], [14].
La présence d’anticorps anti-ENV et IgG affichant des ADCC en l’absence d’une réponse forte d’IgA est en forte corrélation la protection par un vaccin de type 15 RV144 VIH-1, [15] [16]. Chez les personnes infectées par le VIH, la présence d’anticorps ADCC corrèle souvent avec une progression lente de la maladie [12], [13], [14], [17], [18], [19].
Une activité ADCC est également associée à une diminution de la mortalité chez les nourrissons infectés par le VIH [20]. Les anticorps médiateurs du sérum ADCC- ciblent différents epitopes ENV, y compris la boucle variable 3 (V3), la région constante 1 (C1) et la région induite par CD4 (CD4i) [21], [22], elles sont susceptibles d’exercer une pression immunitaire significative sur le virus [21].
L’activité d’ADCC de certains anticorps anti-ENV (y compris b12, 2G12, PGT126, ainsi que A32, qui ciblent un épitope CD4i) a été bien étudiée [12], [23], [24], [25]. Ces anticorps se lient à des glycoprotéines ENV sur la surface cellulaire et provoquent leur mort par les cellules NK. Fait intéressant, le VIH-1 échappent partiellement à l’ADCC. Les protéines du VIH-1 Vpu et Nef réduisent la capacité de certains anticorps (ciblant principalement des épitopes CD4i) pour surperformer lADCC [12], [23], [24], [25].
Les stratégies de guérison visent à cibler les réservoirs latents du VIH-1 à l’intérieur des cellules au repos T CD4 + après une réactivation virale [26]. Les bNAbs associés à des inducteurs viraux diminuent le rebond sur des souris humanisées, grâce à des mécanismes partiellement compris qui peuvent inclure l’élimination directe des cellules infectées [27].
Il est donc important d’examiner la compétence des bNAbs pour appuyer l’efficacité de l’ADCC, de comprendre les mécanismes sous-jacents et de déterminer si bNAbs et ADCC-puissants peuvent être utilisés pour purger ou réduire la taille du réservoir latent.
Nous identifions ici un sous-ensemble de bNAbs qui se lient avec les NK et tuent les cellules VIH-1 infectées. En outre, les cellules infectées réactivées des personnes séropositives exposent des modèles d’épitope hétérogènes ENV, avec des niveaux suffisants pour déclencher l’ADCC par bNAbs.
Discussion
Nous avons analysé ici l’activité ADCC de bNAbs vis à vis de de VIH-1 dérivé du réservoir viral obtenu en laboratoire et ayant réactivé le VIH-1 . Nous rapportons qu’un sous-ensemble de bNAbs tue efficacement les lymphocytes HIV-1-infected.
Tous les anticorps testés contiennent les même régions Fc, ce qui implique que les différences dans la capacité du signal par l’intermédiaire FcyRIII et médian de l’ADCC est dépendante des différentes régions du corps.
Ainsi, les différences d’efficacité pour tuer sont probablement dues à des changements de liaison de l’anticorps et de l’accessibilité de la région Fc lorsqu’elle est liée à des cellules infectées. Les niveaux d’état stable ENV et la stabilité de la surface des bNAbs régulent leur activité ADCC.
Nous démontrons qu’une corrélation significative existe entre l’intensité de la liaison des anticorps à la surface cellulaire, la stabilité de cette liaison à 37 ° C, et l’activité de neutralisation et de leur capacité à éliminer les cellules VIH-1 infectées. En utilisant les anticorps liés 10-1074 et 10-1369, nous démontrons en outre une liaison entre l’affinité d’un anticorps et la protéine Env trimère et son activité d’ADCC.
Nos résultats élargissent les travaux antérieurs montrant que l’affinité de l’anticorps est liée à l’activité de neutralisation [28] et fournissent une analyse déterministe complète de l’activité d’ADCC d’un groupe spécial des nouveaux bNAbs. Nous montrons que l’exposition d’épitope ENV sur les cellules infectées est très variable, en fonction de l’isolat viral. Les travaux à venir vont aider à évaluer le rôle des protéines virales et d’autres facteurs dans la modulation de l’exposition de l’épitope et ADCC. Les lymphocytes T CD4 + activés par PHA provenant de cellules de patients exposent à des quantités suffisantes d’epitopes ENV nécessaires à la reconnaissance par des combinaisons de bNAbs et la destruction par les cellules NK.
Nos expériences offrent une explication suffisamment déterministe quant à la façon que les bNAbs associés aux inducteurs viraux diminuent la reprise des réservoirs latents chez les souris humanisée [27].
Nous montrons en outre que les réservoirs viraux présentent une hétérogénéité extrême dans l’exposition de l’épitope ENV. Ceci reflète la sensibilité variable de virions à partir du réservoir à la neutralisation par les BNA BS 37 [29]. Il serait intéressant de suivre la "vie" des épitopes plus loin dans le temps, afin de déterminer si les virus fondateurs réactivés évoluent au fil du temps, proviennent de clones ou des populations de cellules [30], [31] avec des profils homogènes ou hétérogènes d’ENV.
Chez les personnes infectées par le VIH-1, le taux faible de charge virale, pendant une thérapie antirétrovirale efficace, donne des résultats probables très actif de l’expression du virus d’archives et la réplication virale secrète [32]. Les virus actifs atents se trouvent principalement dans les sous-ensembles de cellules au repos dans des cellules mémoire, qui sont en grande partie inactive pour le gène viral exprimé 35 [33], 41 [34], 42 [35].
Il sera intéressant de déterminer si les bNAbs peuvent tuer des cellules d’efficacités similaires à partir du réservoir latent, ou à partir d’une population de lymphocytes à faible niveau de la réplication. Ceci peut être obtenu par le tri des cellules de mémoire sanctuaire T au repos provenant de patients et d’effectuer des analyses de l’ADCC avec divers activateurs cellulaires ou des agents d’inversion de latence [33].
Il sera également intéressant de déterminer si les bNAbs peuvent tuer les cellules réelles réactivés et infectées de manière latente avant que le virus se propage aux cellules voisines. Ceci peut être réalisé en visualisant la destruction des cellules infectées après réactivation virale chez des modèles de souris humanisées.
Nos résultats démontrent directement que les bNAbs, en plus d’autres interventions immunitaires [36], [37], représentent un outil efficace pour examen dans le « choc et tuer ’des stratégies visant à purger le réservoir viral [14], [26].
Une thérapie basée sur les NAb VIH-1 aura probablement besoin d’une projection personnalisée du motif d’exposition de l’épitope de l’Env sur les cellules réactivées, afin de déterminer la combinaison optimale d’anticorps. Les données rapportées sur les différences entre les bNAbs dans leur capacité à tuer les lymphocytes VIH-1-infected permettra une meilleure compréhension des attributs fonctionnels des anticorps pour les stratégies de prévention et de guérison.
Informations er croquis supplémentaires en anglais
Plus d'informations :
mots clés :
Biological sciences
Immunology
Virology
Notes :
[1] Stamatatos, L., Morris, L., Burton, D. R. & Mascola, J. R. Neutralizing antibodies generated during natural HIV-1 infection : good news for an HIV-1 vaccine ? Nature Med. 15, 866–870 (2009).
[2] McCoy, L. & Weiss, R. Neutralizing antibodies to HIV-1 induced by immunization. J. Exp. Med. 210, 209–223 (2013).
[3] Mouquet, H. Antibody B cell responses in HIV-1 infection. Trends Immunol. 35, 549–561 (2014).
[4] Klein, F. et al. Antibodies in HIV-1 vaccine development and therapy. Science 341, 1199–1204 (2013).
[5] Burton, D. R. & Mascola, J. R. Antibody responses to envelope glycoproteins in HIV-1 infection. Nat. Immunol. 16, 571–576 (2015).
[6] Caskey, M. et al. Viraemia suppressed in HIV-1-infected humans by broadly neutralizing antibody 3BNC117. Nature 522, 487–491 (2015).
[7] Malbec, M. et al. Broadly neutralizing antibodies that inhibit HIV-1 cell to cell transmission. J. Exp. Med. 210, 2813–2821 (2013).
[8] Reh, L. et al. Capacity of broadly neutralizing antibodies to inhibit HIV-1 cell-cell transmission is strain- and epitope-dependent. PLoS Pathog. 11, e1004966 (2015).
[9] Hessell, A. J. et al. Fc receptor but not complement binding is important in antibody protection against HIV. Nature 449, 101–104 (2007).
[10] Bournazos, S. et al. Broadly neutralizing anti-HIV-1 antibodies require Fc effector functions for in vivo activity. Cell 158, 1243–1253 (2014).
[11] Ko, S. Y. et al. Enhanced neonatal Fc receptor function improves protection against primate SHIV infection. Nature 514, 642–645 (2014).
[12] Kramski, M., Stratov, I. & Kent, S. J. The role of HIV-specific antibody-dependent cellular cytotoxicity in HIV prevention and the influence of the HIV-1 Vpu protein. AIDS 29, 137–144 (2015).
[13] Euler, Z. & Alter, G. Exploring the potential of monoclonal antibody therapeutics for HIV-1 eradication. AIDS Res. Hum. Retroviruses 31, 13–24 (2015).
[14] Lee, W., Parsons, M., Kent, S. & Lichtfuss, M. Can HIV-1-specific ADCC assist the clearance of reactivated latently infected cells ? Front. Immunol. 6, 265 (2015).
[15] Haynes, B. F. et al. Immune-correlates analysis of an HIV-1 vaccine efficacy trial. N. Engl. J. Med. 366, 1275–1286 (2012).
[16] Chung, A. W. et al. Dissecting polyclonal vaccine-induced humoral immunity against HIV using systems serology. Cell 163, 988–998 (2015).
[17] Barouch, D. H. et al. HIV-1 vaccines. Protective efficacy of adenovirus/protein vaccines against SIV challenges in rhesus monkeys. Science 349, 320–324 (2015).
[18] Lambotte, O. et al. Heterogeneous neutralizing antibody and antibody-dependent cell cytotoxicity responses in HIV-1 elite controllers. AIDS 23, 897–906 (2009).
[19] Smalls-Mantey, A. et al. Antibody-dependent cellular cytotoxicity against primary HIV-infected CD4+ T cells is directly associated with the magnitude of surface IgG binding. J. Virol. 86, 8672–8680 (2012).
[20] Milligan, C., Richardson, B. A., John-Stewart, G., Nduati, R. & Overbaugh, J. Passively acquired antibody-dependent cellular cytotoxicity (ADCC) activity in HIV-infected infants is associated with reduced mortality. Cell Host Microbe 17, 500–506 (2015).
[21] Chung, A. W. et al. Immune escape from HIV-specific antibody-dependent cellular cytotoxicity (ADCC) pressure. Proc. Natl Acad. Sci. USA 108, 7505–7510 (2011).
[22] Richard, J. et al. CD4 mimetics sensitize HIV-1-infected cells to ADCC. Proc. Natl Acad. Sci. USA 112, E2687–E2694 (2015).
[23] Alvarez, R. A. et al. HIV-1 Vpu antagonism of tetherin inhibits antibody-dependent cellular cytotoxic responses by natural killer cells. J. Virol. 88, 6031–6046 (2014).
[24] Arias, J. F. et al. Tetherin antagonism by Vpu protects HIV-infected cells from antibody-dependent cell-mediated cytotoxicity. Proc. Natl Acad. Sci. USA 111, 6425–6430 (2014).
[25] Pham, T. N., Lukhele, S., Hajjar, F., Routy, J.-P. P. & Cohen, É. A. A. HIV Nef and Vpu protect HIV-infected CD4+ T cells from antibody-mediated cell lysis through down-modulation of CD4 and BST2. Retrovirology 11, 15 (2014).
[26] Deeks, S. G. et al. Towards an HIV cure : a global scientific strategy. Nat. Rev. Immunol. 12, 607–614 (2012).
[27] Halper-Stromberg, A. et al. Broadly neutralizing antibodies and viral inducers decrease rebound from HIV-1 latent reservoirs in humanized mice. Cell 158, 989–999 (2014).
[28] Scheid, J. F. et al. Sequence and structural convergence of broad and potent HIV antibodies that mimic CD4 binding. Science 333, 1633–1637 (2011).
[29] Chun, T.-W. W. et al. Broadly neutralizing antibodies suppress HIV in the persistent viral reservoir. Proc. Natl Acad. Sci. USA 111, 13151–13156 (2014).
[30] Maldarelli, F. et al. Specific HIV integration sites are linked to clonal expansion and persistence of infected cells. Science 345, 179–183 (2014).
[31] Cohn, L. B. et al. HIV-1 integration landscape during latent and active infection. Cell 160, 420–432 (2015).
[32] Tobin, N. H. et al. Evidence that low-level viremias during effective highly active antiretroviral therapy result from two processes : expression of archival virus and replication of virus. J. Virol. 79, 9625–9634 (2005).
[33] Bruner, K. M., Hosmane, N. N. & Siliciano, R. F. Towards an HIV-1 cure : measuring the latent reservoir. Trends Microbiol. 23, 192–203 (2015).
[34] Chomont, N. et al. HIV reservoir size and persistence are driven by T cell survival and homeostatic proliferation. Nature Med. 15, 893–900 (2009).
[35] Ruelas, D. S. & Greene, W. C. An integrated overview of HIV-1 latency. Cell 155, 519–529 (2013).
[36] Shan, L. et al. Stimulation of HIV-1-specific cytolytic T lymphocytes facilitates elimination of latent viral reservoir after virus reactivation. Immunity 36, 491–501 (2012).
[37] Pegu, A. et al. Activation and lysis of human CD4 cells latently infected with HIV-1. Nat. Commun. 6, 8447 (2015).
