Le VIH et ses sanctuaires : vision dynamique
 mercredi 30 mars 2016
mercredi 30 mars 2016 
Dans un article du 16 juillet 2015, les scientifiques estimaient qu’avec de nombreux moyens financiers et une politique
sanitaire très pro-active, le virus VIH pouvait être éradiqué d’ici 2030. l’Onusida en avait fait une politique mondiale, la mairie de Paris avait repris cette politique.
Mais c’était sans compter sur ce que tous redoutaient et qui a commencé à devenir une réalité : les sanctuaires du VIH. De nombreuses études scientifiques travaillent sur la découvertes de ces sanctuaires. Dans cet article traduit de la revue Nature, nous allons expliciter le comportement dynamique entre un de ces sanctuaires et le reste du corps humain.
Le concept réside dans la mesure des doses de médicaments, d’analyser leur pénétration dans les sanctuaires où l’on trouve encore des virus de primo infection. Ces études permettent de constater si ces primo virus peuvent reprendre le dessus sur les virus qui ont subit des mutations et si les de fortes doses de médicaments peuvent les éliminer de ces sanctuaires.
Comme ce document scientifique peut paraître ardus et est surtout long, j’ai pensé commencer par la conclusion. Les plus courageux(ses) auront tout le loisir d’étudier la suite.
Prochaine étape : un espoir en provenance de l’INSERM.
Les auteurs :
Ramon Lorenzo-Redondo1, Helen R. Fryer, Trevor Bedford, Eun-Young Kim1, John Archer, Sergei L. Kosakovsky Pond,
Yoon-Seok Chung, Sudhir Penugonda, Jeffrey G. Chipman, Courtney V. Fletcher, Timothy W. Schacker, Michael H. Malim,
Andrew Rambaut, Ashleantirétrovirauxy T. Haase , Angela R. McLean & Steven M. Wolinsky
Conclusion
Nos résultats révèlent le dynamisme et que les processus spatiaux agissent ensemble pour permettre au VIH-1 de persister dans l’hôte infecté et éviter le développement de la résistance malgré un traitement antirétroviral.
A partir de l’étude dans le temps et comportementales, sur des données structurées, nous concluons que la poursuite de
la production de virus à partir des cellules infectées dans les sites de
sanctuaire de tissus lymphoïdaires, où les concentrations de médicaments ne sont pas entièrement suppressives, peuvent continuer à reconstituer le réservoir viral et sa circulation dans le sang ou tissus lymphoïdaires [18].
Nous démontrons en outre que le virus ne développe pas nécessairement une résistance aux médicaments antirétroviraux parce que la plus faible concentration de médicaments dans
les sites de sanctuaire ne suffit pas à conférer un avantage concurrentiel sur les souches résistantes aux médicaments.
Nos résultats expliquent l’échec du traitement d’intensification à supprimer totalement l’infection primaire et mettre en évidence
les questions entourant les obstacles à la prescription des médicaments antirétroviraux dans des concentrations cliniquement efficaces dans le réservoir infectieux viral.
L’approche state-of-the-art de séquençage, échelonné régulièrement, et la construction innovante de l’arborescence phylogénétique, ainsi que le nouveau modèle de compartimenter la dynamique intra-hôte dynamique de la population fournissent une nouvelle perspective sur la persistance du VIH-1 dans le corps.
La réalisation de pharmacocinétique cellulaire optimale et la distribution spatiale des médicaments antirétroviraux dans les tissus lymphoïdaires pour supprimer complètement la réplication virale et préserver la fonction immunitaire serait une condition préalable à l’élimination du réservoir viral et finalement, une étape vers un remède contre l’infection au VIH-1.
Introduction
Le tissus lymphoidaire est un réservoir clé établi par le VIH 1 pendant l’infection aiguë. C’est un site associé à la production virale,
le stockage de particules virales dans des complexes immunisés et viralement persistant. Bien que les combinaisons
de médicaments (drogues) antirétroviraux suppriment d’habitude la reproduction virale et réduisent l’A.R.N. viral à
un niveau non détectables dans le sang, il est non déterminant que le traitement supprime entièrement la reproduction virale
dans des réservoirs tissulaires lymphoides. Ici nous montrons que l’évolution virale et le trafic entre des compartiments tissulaires
continuent dans des patients à niveau non détectable de virus dans leur système sanguin.
Nous présentons un modèle spatial et dynamique de reproduction virale persistante et nous étendons notre réflexion
sur le fait la résistance médicamenteuse et les concentrations de médicaments sont insuffisantes pour complètement bloquer
la reproduction virale.
Ces données fournissent de nouveaux aperçus dans l’évolution et la dynamique d’infection de la population virale dans l’hôte,
révélant que le VIH 1 peut continuer à se reproduire et remplir de nouveau le réservoir viral malgré la thérapie antirétrovirale puissante.
Des combinaisons de médicaments antirétroviraux diminuent régulièrement la réplication et la production du HIV-1 à
des niveaux indétectables dans le sang à à partir des premières semaines de traitement [1]. Néanmoins, aucun des traitements actuels,
n’est capable d’éradiquer le virus à partir d’un réservoir à long terme des cellules CD4 +T et d’autres types de cellules
qui protègent potentiellement le virus de médicaments antirétroviraux et de la surveillance immunitaire [2] [3]
[4]
[5].
La production intermittente de virus à partir de la réactivation d’une faible proportion latente de
cellules T CD4 + infectées (plutôt que de faibles taux de réplication en cours) correspond au rebond viral détecté dans le sang des patients traités ayant apparemment une infection supprimée [6] [7] [8].
La réplication continue n’a pas été considérée possible, car ni la divergence génétique virale dans le temps, ni
l’émergence de mutations de résistance aux médicaments n’ont été convaincantes et documentées [9] [10].
Comme des études antérieures ont examiné uniquement des séquences virales dérivées du sang de patients qui ont continué à supprimer la réplication virale dans ce compartiment anatomique [11], les conclusions ne sont pas nécessairement généralisables à d’autres compartiments dans le corps, en particulier au tissus lymphoïdaires où la fréquence d’infection par cellule est le plus souvent supérieure [12] et où les concentrations de médicament intracellulaires sont beaucoup plus bas que dans le sang [13]. Sous de faibles concentrations de médicament, le virus peut cLemey, P., Rambaut, A., Drummond, A. J. & Suchard, M. A. Bayesian phylogeography finds its roots. PLOS Comput. Biol. 5, e1000520 (2009).ontinuer à se reproduire et a évoluer dans des « sites de sanctuaire » grâce aux réservoirs de cellules dans des tissus lymphoïdaires, et rester indétectable dans le sang pendant un certain temps selon la dynamique migratoire de la population entre les deux
compartiments.
Ici, nous utilisons une stratégie à plusieurs volets de profondeur de séquençage, analyse phylogénétique temps calibré, et de la modélisation mathématique pour caractériser la structure temporelle distincte et la divergence des séquences virales de façon fragmentaire échantillonnés.
Nous découvrons la réplication continue en lymphoïdes sites sanctuaire de tissus de patients à taux sanguin de virus indétectable.
Notre méthode d’échantillonnage diffère fondamentalement
de ceux des études précédentes [14] [15] [16], qui ne tiennent pas compte de l’évolution
dynamique dans le tissus lymphoïdaires, et convient mieux à une enquête de la nature dynamique du réservoir viral pendant
le traitement avec de puissants
médicaments antirétroviraux.
Pour étudier l’évolution et la dispersion spatiale des virus avec une grande précision, nous séquençons profondément (en utilisant la plate-forme de séquençage GS FLX (Roche) le VIH-1 dans l’ADN des cellules du sang et les ganglions lymphatiques inguinaux.
Trois sujets ont été recueillis lors de trois époques différentes (au jour 0, et après 3 et 6 mois de traitement), décrits par ailleurs [13]. Les travaux antérieurs ont établi que des séquences virales simultanément échantillonnées à partir du
tissus lymphoïdaires dans différents horizons sont génétiquement homogènes [17],
compatible avec le trafic des CD4 + T dans les tissus cellulaires [18]. Par conséquent,
l’évaluation détaillée d’une partie d’un ganglion lymphatique n’est pas en mesure de biaiser l’analyse de larges échantillons anatomiques.
Nous avons également séquencé
l’ARN viral dans le plasma, à J 0, à partir des trois sujets de l’étude. Deux sujets (1727 et 1679) avaient un degré d’infection de charge virale <48 (copies de génome par ml de plasma) ; et le troisième objet (1774) a continué à avoir des quantités mesurables de l’ARN viral
dans le plasma au bout de 3 mois, mais qui ont décliné vers 6 mois.
Les sujets 1727 et 1679 infectés par le VIH-1 depuis 3 à 4 mois
étaient en traitement antirétroviral avant l’étude. Le sujet 1774 était infectées par le VIH-1 depuis 17 ans et a été en thérapie antirétroviral, puis sans traitement pendant au moins une année avant l’étude.
Nous avons aligné des séquences de reads (nucléotides : CTAG) avec une longueur moyenne de 548 paires de bases
(Pb) afin d’obtenir un consensus homogène pour chaque patient en utilisant des références
déjà assemblées valides, et corrigées des erreurs de séquençage et des pollutions génétiques [19]. Nous avons ensuite utilisé une approche précédemment décrite pour reconstruire le nombre minimum d’haplotypes virales nécessaires pour expliquer de manière significative l’analyse des reads.
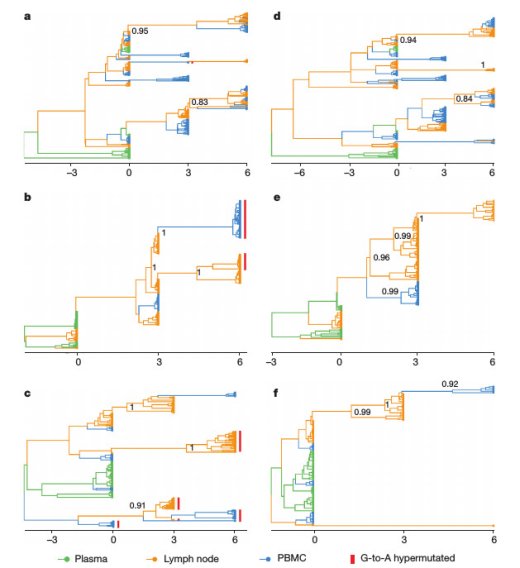
VIH-1 chez les sujets 1774, 1727 et 1679 avec tous les haplotypes (a, b, et c,
respectivement) et avec les haplotypes contenant des mutations-G-A qui ont été supprimées (d, e et f, respectivement).
Les branches de couleurs représentent la plus
probable (modal) emplacement anatomique de leur noeud descendant déduite
par la reconstruction bayésienne de l’état ancestral, avec les
probabilités postérieures de l’emplacement le plus probable des nœuds principaux.
L’abscisse représente le temps en mois à compter de l’ouverture
du traitement. Les PBMC, les cellules mononucléaires du sang périphérique.
Nous avons calculé le taux d’erreur de séquençage et mis la coupure pour la suite de l’analyse en utilisant une séquence de contrôle interne connue. Nous n’avons trouvé aucune preuve significative pour les séquences de recombinaison qui pourrait biaiser l’analyse. Une couverture élevée nous a permis de corriger les erreurs de PCR et de séquençage (en conservant une moyenne de 25.000 longs reads finaux par échantillons) et de détecter des variantes présentent dans au moins 0,04% de la population de virus.
Les séquences de la région Pol du VIH-1 qui a recouvert
la région génomique codant pour les enzymes protéase ou les inverses virales de transcriptase, n’ont montré aucun signe de nouvelles mutations qui confèrent une résistance
ment aux médicaments antirétroviraux utilisés.
Pour éviter les incertitudes dans la détection des haplotypes en raison de la dispersion des échantillons et afin de prévenir une analyse évoluée systématiquement biaisée, nous avons mis en place un plus grand nombre de modèles de molécules dont la profondeur des données de séquençage varie par 9,6 fois dans une plage de 3.2- à 362 fois.
La couverture élevée de séquençage ultra-profonde assure une détection fiable de faible variants viraux de fréquence.
L’abscisse sur les parcelles représente le temps en mois à compter de l’ouverture du traitement. Les PBMC, les cellules mononucléaires du sang périphérique.
la fréquence apparait au-dessus de la fréquence de 1% de la réplication ; 97,7% des haplotypes en dessous de 1% de fréquence sont apparus en dessous de 1% la fréquence dans de réplication),
ce qui indique que la représentation des haplotypes n’est pas biaisé notamment par des amplifications aléatoires de certaines séquences et pas d’autres. Le haut degré de concordance entre les répétitions techniques a validé notre approche pour le calcul de la caractérisation des populations virales qui est robuste par rapport à l’erreur expérimentale et effet [20].
Les phylogénies montrent une structure temporelle
Les haplotypes inférés correspondant aux régions Gag ou Pol du
VIH-1 qui ont été soumis à des procédés de phylogénie maximum estimée de vraisemblance.
Nous avons masqué le guano-sinusoïdales des sites d’édition qui tombent dans des contextes de tri nucléotides
ciblés par cellular APOBEC3 protéines APOBEC 3D, APOBEC3F, APOBEC3G, et APOBEC3H des alignements afin d’éviter la déformation et conserver la informations phylogénétique [20].
Les relations phylogénétiques entre les haplotypes distincts ont montré une structure cohérente avec l’horloge moléculaire (c’est à dire des substitutions continues nucléotidiques qui se produisent à un taux constant), comme en témoigne la forte corrélation entre la distance
des racine-à-bout et la date d’échantillonnage dans les analyses de régression (malgré les branches courtes).
Le support principal calculé utilisant un ratio de probabilité de test est approximatif et la proportion de sites qui sont différents (la p-distance) vérifient la divergence des haplotypes entre le jour 0 et après 6 mois de traitement dans la plupart du Gag et des régions Pol de VIH 1
analysé (la Table de Données Prolongée).
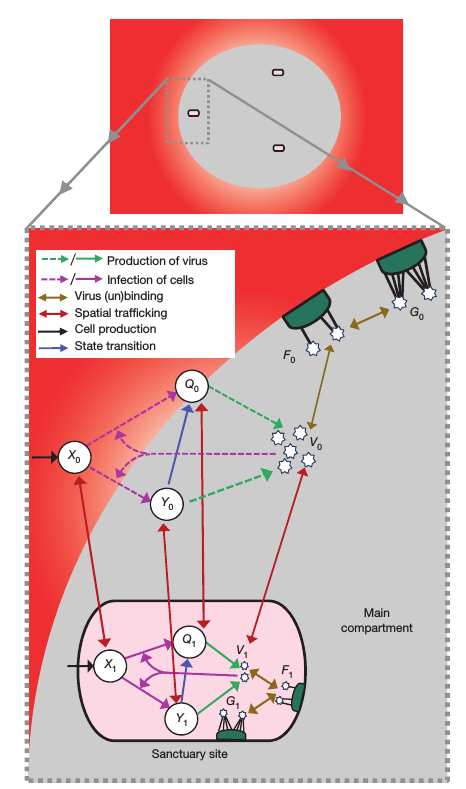
le sang), la concentration de médicament est élevé (gris et rouge).
Dans ce sanctuaire (i = 1, une petite fraction du tissu lymphoïde et est localisé
par un liquide extracellulaire), la concentration du médicament est faible (rose).
Il y a des cellulnon infectées (X i), des cellules infectées à durée de vie plus
longue (Yi), et d’autre de courte durée des cellules (Qi), ainsi que des particules
virales (Vi) qui peuvent être liées par quelques (Fi) ou beaucoup
(Gi) des récepteurs du réseau cellulaire dendritique folliculaire.
Les lignes en pointillés
représentent l’effet du traitement dans le blocage de l’infection et la production deL
particules virales infectieuses. Pour plus de simplicité graphique,
nous ne montrons pas l’émergence d’une résistance aux médicaments,
la production de particules virales non contagieuses, le dégagement viral, ni la
mort cellulaire.
En accord avec la reproduction suivie plutôt qu’échantillonner des populations virales différentes dans des ganglions lymphatiques, des nœuds viraux à la même époque échantillonnés dans les tissus lymphoidaires et le sang ont montré un degré semblable de divergence.
avec des médicaments sensibles (RS, ligne orange) et partiellement résistant
aux médicaments (RR, ligne bleue) sont pilotés par la concentration de médicament
efficace dans le compartiment concerné. Les lignes verticales noires marquent
les seuils de séparation avec trois résultats possibles. Lorsque les concentrations
de médicaments efficaces sont faibles, le
bénéfice de la résistance aux médicaments ne résout pas le coût de remise
en forme des mutations
et les souches sensibles aux médicaments dominent.
La replication du virus est suffisante pour
soutenir la production de souches partiellement résistantes aux médicaments,
mais ces souches seront surpassés car en trop faible nombre et le temps d’attente
pour générer des souche résistante aux médicaments sera très long. Cependant à des
concentrations de médicament efficaces intermédiaires, souches partiellement résistant
aux médicaments, domineront. À des concentrations élevées, les deux RS et RR chutent
en dessous d’une
ligne rouge, ni la souche peut se développer et la réplication du virus est stoppé.
Avec le déplacement des haplotypes qui ont trouvé comme hébergement de substitution des bases inactivantes répétitives de guanosine-adénosine (G-to-A), la lignée émergente est apparue et a mené jusqu’à l’APOBEC3 servant d’événement d’intermédiation, d’hypermutation et une estimation de taux évoluant (l’échelle de 6.24 × 10-4 à 1.02 × 10-3 substitutions par site par mois ; la table de Données Prolongée(Étendue) [2]) est corroborée avec ceux d’évaluations virales intra-hôtes (la gamme, 5.22 × 10-4 à 8.42 × 10-4 substitutions par site par mois) [21].
Nous concluons donc que la réplication virale continue, contribue au réservoir viral.
Les populations virales montrent une structure compartimentée.
L’indice de fixation par paires (FST), une mesure standard de différenciation génétique entre les populations et le plus proche voisin ancestral statistique (Snn), aussi une mesure des relations spatiales dans les populations, a confirmé la variation génétique importante entre les ganglions lymphatiques et le sang au niveau de chaque
point intermédiaires (Extended Table de données 3) [22], [23].
Comme l’évolution de la séquence dans compartiments spatialement distincts peuvent être affectés par la sélection différentielle, nous avons utilisé une branche test modèle à effets aléatoires sans restriction afin de tester si la proportion de sites le long d’un sous-ensemble des branches d’arbres soumis à la diversification épisodique de sélection est significativement différent de zéro [24].
Nous avons limité le test des branches internes, qui capturent au moins un, mais probablement plusieurs, cycles de réplication virale pour réduire les effets de polarisation neutre ou des mutations délétères sur le rapport de non synonyme à synonyme, taux de substitution (ω) estimant que la sélection n’a pas encore complètement filtré de telles variations de niveau de la population [25], [26].
Sauf pour un sujet d’étude (1679), où une petite proportion de sites (0,3%) étaient sous forte diversifiance, la sélection positive le long des branches d’arbre interne (test du rapport de vraisemblance, P ≈ 10-6), nous a permis de trouver peu de preuves pour suggérer que le virus évolue en réponse aux forces sélectives fortes. Nous en avons conclu qu’il n’y a qu’une migration restreinte des haplotypes d’un compartiment à l’autre.
L’histoire phylo-anatomique du VIH-1
Permettant de déduire les modèles évolutifs et des processus
de dynamique de population à partir des données d’ordre structurées dans le temps, nous avons utilisé une statistique bayésienne cadre, qui estime que le taux de substitution, le temps de divergence, et l’histoire démographique des lignées virales échantillonnées pour structurer et résoudre la base phylogénie [27], [28].
Cette approche résout des modèles d’évolution qui interfèrent dans le temps, les directions clés, migrations du virus au sein des hôtes. La figure 1 montre l’histoire phylo-anatomique du VIH-1 dont les sujets d’étude ont déduit de l’héréditaire et du descendant haplotypes cadrant avec un maximum Bayésien clade la crédibilité (MCC) de l’arbre phylogénétique.
Les motifs de ramification dans les arbres, qui reconstitue les origines et le suivi le flux du VIH-1 dans les hôtes, et le tissu d’origine des nœuds internes, montrent un fort support potentiel statistique (mis en évidence par leurs probabilités a posteriori).
la longueur des branches dans ces structures arborescentes (panneaux de gauche avec tous les haplotypes ; panneaux de droite
avec les G-à-A séquences hypermutées putatifs enlevées pour éviter des distorsions) représentent des estimations médianes postérieures dans le temps.
la structure temporelle arborescente montre un fort signal régulier et de taux compatibles avec l’évolution intra-hôte du VIH-1. Le meilleur modèle inclus une horloge moléculaire rigoureuse, permettant d’assurer une taille de population constante, mais un modèle avec une horloge moléculaire détendue donne qualitativement des résultats similaires (données non présentées).
Basé sur la topologie d’arbre MCC déduite et les attributions de compartiment aux nœuds internes non observés, une conformité sous-jacente et une corrélation forte existent entre la localisation génétique, anatomique et la direction de diffusion du virus dans le corps.
Un modèle particulier se reproduit : les haplotypes dans des ganglions lymphatiques sont la source des origines virales qui migrent du ganglion lymphatique au sang (l’image 1).
Nous en déduisons que les lignées virales dans le sang sont dérivées de la réplication du virus dans les nœuds de lymphe avec peu ou pas de preuve d’une source supplémentaire dans le sang.
Les arborescences temporelles montrent un résultat fort et significatif et sont un modèle robuste de substitution. Ces données révèlent seulement par un échantillonnage réalisé temporairement et spatialement, un soutien supplémentaire à la conclusion selon laquelle le modèle ne provient pas de populations distinctes
des haplotypes échantillonné à partir de différents compartiments, mais plutôt la migration et la colonisation des haplotypes entre les tissus lymphoïdaires et le sang.
Un modèle de coalescence structuré [29], moins sujette à un biais potentiel dans l’estimation d’inférence spatiale, montre des taux de migration plus élevés des nœuds de lymphe vers le sang (Extended Table de données 5), confirmant que la direction de l’écoulement n’est pas due à un sur échantillonnage d’un emplacement anatomique particulier qui aurait augmenté les estimations de trafic dans cet emplacement [30].
Nos résultats, qui reconstruisent la dynamique de la propagation du VIH-1 à l’intérieur du corps, implique que chez les patients sans ARN viral détectable dans le plasma, le réservoir du virus est constamment renouvelé par la réplication du virus de bas niveau dans le tissus lymphoïdaire.
Distinguer entre les faibles quantités de la réplication virale et des pools de cellules infectées de façon latente qui peuvent persister
et réactiver l’infection du VIH-1 est méthodologiquement difficile.
Un petit nombre de VIH 1 d’ordres isolés qui ont persisté régulièrement sans preuve évidence de changement génétique pouvant résulter longtemps - peuvent être le résultat de cette survivance centrale, dont une fraction peut être retourné à un état de repos, ou infecter de façon larvée les cellules de mémoire transitoires qui persistent par l’expansion clonale (conduit par la prolifération homéostatique) ou la survie de CD4+ T infectées de longue date les cellules qui contiennent des virus contaminant [8],[<15>]], [22], [31] [32] [33].
Deux des sujets (1774 et 1679) ont montré que certains
haplotypes persistent comme une arborescence unique à travers le temps (Fig. 1d et f). ils sont compatibles avec la prolifération des cellules du VIH-1 ou infectés par la cellule de survie à long terme
[34]. Indépendamment des différents mécanismes d’auto-renouvellement/persistance dont certains d’entre eux latents ou défectueux assez similaires aux lignées virales peuvent avoir persisté. Ces virus de repos diffèrent d’autres qui ont évolué et migré entre les compartiments.
Les données échantillonnés de façon fragmentaire montrent que les lignées virales continuent à diverger chez les patients traités et à faible charge virale. Cela aide à expliquer
la persistance de réservoirs viraux infectieux avec peu de réduction du stock de virus [35].
La nature dynamique de la population virale dans les sanctuaires tissulaires lymphoïdes, là où les tissus des cellules infectées peuvent encore produire de nouveaux virus, continuent
à infecter de nouvelles cellules cibles, et reconstituent le pool des précédentes estimations du temps nécessaire pour purger le réservoir de manière latente des cellules infectées et parvenir à l’éradication du virus [3].
un model spatial et dynamique
Bien que la diversité génétique virale ce soit accumulée au fil du temps, l’infection des cellules ne produisent pas de nouveau virus avec des mutations de résistance aux médicaments, ce qui confère un avantage de remise en forme putative qui aurait pu conduire à une approche systémique d’un rebond viral.
Pour fournir une explication plus déterministe de ce scénario,
nous avons développé un modèle mathématique avec une concentration-dépendante de médicaments en fonction de la réplication virale et la propagation entre les compartiments
spatialement distincts pour explorer les composantes déterministes de la dynamique virale [36].

le sang), la concentration de médicament est élevé (gris et rouge).
Dans ce sanctuaire (i = 1, une petite fraction du tissu lymphoïde et est localisé
par un liquide extracellulaire), la concentration du médicament est faible (rose).
Il y a des cellulnon infectées (X i), des cellules infectées à durée de vie plus
longue (Yi), et d’autre de courte durée des cellules (Qi), ainsi que des particules
virales (Vi) qui peuvent être liées par quelques (Fi) ou beaucoup
(Gi) des récepteurs du réseau cellulaire dendritique folliculaire.
Les lignes en pointillés
représentent l’effet du traitement dans le blocage de l’infection et la production deL
particules virales infectieuses. Pour plus de simplicité graphique,
nous ne montrons pas l’émergence d’une résistance aux médicaments,
la production de particules virales non contagieuses, le dégagement viral, ni la
mort cellulaire.
Dans ce modèle (voir Fig. 2), le virus peut occuper deux compartiments spatialement distincts qui ont des points de circulation réguliers mais limités, des particules de virus ou de cellules. Le compartiment principal a un plus grand volume et une forte concentration de médicament efficace.
L’autre, plus petit compartiment de volume (<0,01% de la taille du compartiment principal) présente une plus faible concentration de médicament et représente un site dans le sanctuaire lymphoïde. Le modèle comprend la concurrence entre les deux virus les souches 37, qui est sensible à une puissante polythérapie qui est partiellement résistant à la liste complète des médicaments antirétroviraux,
mais qui sont moins réactif que la souche sensible aux médicaments, en l’absence de traitement.
Au sein de chaque compartiment l’équilibre entre les souches est déterminée par la différence de leur capacité réplicative sans traitement, l’efficacité du traitement médicamenteux pour freiner de nouveaux cycles d’infection dans cette région (déterminée par la concentration de médicament),et la pouvoir de chaque souche face à la thérapie antirétrovirale [37].
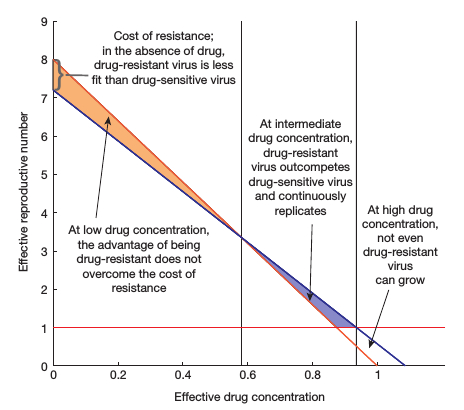
La figure 3 illustre la remise en forme hypothétique, qui dépeint
la relation entre la condition physique de chaque souche et l’évolution,
l’adaptation à travers une gamme de concentrations de médicament.
Le paysage de sanitaire explique la persistance de l’association importante de virus qui est inchangé par l’effet anti-retroviral des médicaments. Le nombre de reproducteur effectif R (le nombre moyen
de secondaires de primo infections de cellules, produites par une cellule infectée) est une fonction du nombre R0 reproducteur de base et l’efficacité de traitement R = R0 en absence de traitement).
Le coût de remise en forme de la résistance aux médicaments détermine la différence entre le nombre de reproduction
efficace pour les souches sensibles aux médicaments et les résistantes
aux médicaments (RS et R R, respectivement) à zéro concentration efficace du médicament.
Dans un système compétitif où les deux souches sont présentes,
le maximum des deux nombres efficaces de reproduction RS et RR est égale à la reproduction effective Numéro de R pour le système dans son ensemble à cette concentration efficace du médicament.

avec des médicaments sensibles (RS, ligne orange) et partiellement résistant
aux médicaments (RR, ligne bleue) sont pilotés par la concentration de médicament
efficace dans le compartiment concerné. Les lignes verticales noires marquent
les seuils de séparation avec trois résultats possibles. Lorsque les concentrations
de médicaments efficaces sont faibles, le
bénéfice de la résistance aux médicaments ne résout pas le coût de remise
en forme des mutations
et les souches sensibles aux médicaments dominent.
La replication du virus est suffisante pour
soutenir la production de souches partiellement résistantes aux médicaments,
mais ces souches seront surpassés car en trop faible nombre et le temps d’attente
pour générer des souche résistante aux médicaments sera très long. Cependant à des
concentrations de médicament efficaces intermédiaires, souches partiellement résistant
aux médicaments, domineront. À des concentrations élevées, les deux RS et RR chutent
en dessous d’une
ligne rouge, ni la souche peut se développer et la réplication du virus est stoppé.
Avec deux compartiments spatiaux, l’hétérogénéité dans la répartition des médicaments peut conduire à une hétérogénéité dans R. Dans le site sanctuaire, où le médicament a une faible pénétration, la pression médicamenteuse sélective sur le virus répliquant est trop faible pour compenser les coûts de remise en forme associés à la résistance ; Ainsi, le nombre de reproduction d’une dose de médicament
sensible est supérieure à celle de la souche partiellement résistante
aux médicaments (RS> RR), permettant l’infection des primo virus dominée par la souche sensible aux drogues.
Comme l’efficacité des médicaments augmente, la souche partiellement résistante aux médicaments devient progressivement plus forte par rapport à la
souche sensible aux drogues de telle sorte que, à des concentrations de médicaments intermédiaires, caractérisées par des niveaux de seuil, le nombre de reproduction efficace pour la souche résistante peut être supérieure à celle de la souche sensible aux drogues (RR> RS). Cela permettrait aux cellules primo infectées d’être dominées par la souche partiellement résistante aux médicaments.
Cependant, dans notre modèle, nous supposons que la concentration du médicament dans le compartiment principal dépasse ce seuil. A cette concentration élevée de médicament, l’infection est pas
plus durable parce que le nombre de reproduction efficaces (RR et
RS) sont inférieures à un pour les deux souches.
En supposant un modèle relativement simple à deux compartiments avec une concentration de médicaments de différente de concentration entre eux, le modèle prédit
que les virus, dominés par la souche sensible aux drogues, peuvent proliférer dans un petit site sanctuaire où la concentration de médicament est faible.
Bien que toutes mutations ponctuelles seront générées suffisamment souvent pour inciter les souches partiellement résistantes aux médicaments chez les individus, leur nombre pourrait rester bas grâce à cette concurrence.
La probabilité est extrêmement faible (Voir Renseignements supplémentaires et Tableau complémentaire 2) qu’une
accumulation de mutations d’une souche partiellement résistante aux médicaments lui confère une résistance à tous les médicaments, dont chacun apparaient pour se fixer en l’absence de sélection des médicaments (Figuure. 4) ou la présence ou l’absence de recombinaison.
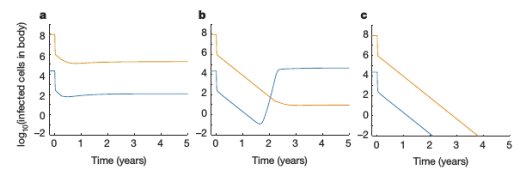
par les médicaments sensibles (ligne orange) ou partiellement résistant aux médicaments (ligne bleue) souches dans le
corps pendant le traitement sont présentés.
Dans le compartiment principal, les combinaisons
de médicaments qui inhibent la transcriptase inverse et de la protéase virale
contrôle l’infection par le virus sensibles aux médicaments. Les concentrations
de médicaments efficaces de l’inhibiteur de la transcriptase inverse (z 0) et l’inhibiteur de protéase (z ? 0) dans
ce compartiment sont donc égale à 1 (z 0 = z ? 0 = 1).Dans le sanctuaire
site, nous modélisons trois scénarios différents.
A, Les concentrations de médicaments efficaces des deux classes de médicaments dans le sanctuaire (z 1 et ? Z 1) sont faibles
(z 1 = Z 1 = 0,3) favorisant les souches sensibles aux médicaments. Ici, des
souches résistantes partiellement aux médicaments existent, mais à des niveaux
inférieurs à ceux favorisant par étapes l’évolution vers une souche totalement
résistante aux médicaments.
B, intermédiaire efficace, les concentrations de médicament (z 1 = Z 1 = 0,6)
favorisent une résistance partielle du virus partiellement aux médicaments à un
niveaux qui peut être suffisant pour l’évolution vers une pharmaco-résistance.
C, des concentrations élevées de médicaments efficaces (z 1 = Z 1 = 1) favorisent
la baisse de toutes les souches vers un arrêt de la réplication du virus.
Les calculs du modèle montrent que l’augmentation de l’efficacité des médicaments ou de la pénétration à travers régions spatiales peuvent affecter la dynamique évolutive, et conduire soit à l’émergence de souches résistantes aux médicaments (Fig. 4b) ou l’élimination
de la réplication continue.
Nos prédictions du modèle correspondent bien aux données
et confirment que la concurrence entre les deux souches et l’hétérogénéité spatiale régionale des concentrations antirétroviraux
permettent de capturer la dynamique observée du réservoir viral dans ces patients comme étant bien supprimée.
Bien que les modèles probabilistes suggèrent (et ce modèle le permet)
la production de souches partiellement résistantes aux médicaments,
Ainsi malgré tout ce qui peut arriver dans le site sanctuaire à cause de la faible pénétration de la drogue et de la concurrence à partir de souches sensibles aux médicaments, ne permet pas peuvent pas de
repeupler le plus grand compartiment principal, où des concentrations élevées de médicaments excluent toute réplication continue.
En accord avec notre inférences phylogénétiques, ces résultats suggèrent que le faible niveau viral et la réplication dans les tissus lymphoïdaires où la concentration des médicaments
antirétroviraux est faible pourrait permettre à des souches sensibles aux médicaments à croître et retombées pour atteindre le sang [38].
Conclusion
Nos résultats révèlent le dynamisme et que les processus spatiaux agissent ensemble pour permettre au VIH-1 de persister dans l’hôte infecté et éviter le développement de la résistance malgré un traitement antirétroviral.
A partir de l’étude dans le temps et comportementales, sur des données structurées, nous concluons que la poursuite de la production de virus à partir des cellules infectées dans les sites de sanctuaire de tissus lymphoïdaires, où les concentrations de médicaments ne sont pas entièrement suppressive, peuvent continuer à reconstituer le réservoir viral et sa circulation dans le sang ou tissus lymphoïdaires [18].
Nous démontrons en outre que le virus ne développe pas nécessairement une résistance aux médicaments antirétroviraux parce que la plus faible concentration de médicaments dans
les sites de sanctuaire ne suffit pas à conférer un avantage concurrentiel sur les souches résistantes aux médicaments.
Nos résultats expliquent l’échec du traitement d’intensification de supprimer totalement l’infection primaire et mettre en évidence
les questions entourant les obstacles à la prescription des médicaments antirétroviraux dans des concentrations cliniquement efficaces dans le réservoir infectieux viral.
L’approche state-of-the-art de séquençage, échelonné régulièrement, et la construction innovante de l’arborescence phylogénétique, ainsi que le nouveau modèle de compartimentés la dynamique intra-hôte dynamique de la population fournissent une nouvelle perspective sur la persistance du VIH-1 dans le corps.
La réalisation de pharmaco-cinétique cellulaire optimale et la distribution spatiale des médicaments antirétroviraux dans les tissus lymphoïdaires pour supprimer complètement la réplication virale et préserver la fonction immunitaire serait une condition préalable à l’élimination du réservoir viral et finalement, une étape vers un remède contre l’infection au VIH-1.
Notes :
[1] Perelson, A. S. et al. Decay characteristics of HIV-1-infected
compartments during combination therapy. Nature 387, 188–191
(1997).
[2] Chun, T. W. et al. Quantification of latent tissue reservoirs and total body viralload in HIV-1 infection. Nature 387, 183–188 (1997)
[3] Finzi, D. et al. Latent infection of CD4+ T cells provides a mechanism for
lifelong persistence of HIV-1, even in patients on effective combination therapy. Nature Med. 5, 512–517 (1999)
[4] Finzi, D. et al. Identification of a reservoir for HIV-1 in patients on highly active
antiretroviral therapy. Science 278, 1295–1300 (1997).
[5] Wong, J. K. et al. Recovery of replication-competent HIV despite prolonged
suppression of plasma viremia. Science 278, 1291–1295 (1997)
[6] Brenchley, J. M. et al. T-cell subsets that harbor human immunodeficiency virus (HIV) in vivo : implications for HIV pathogenesis. J. Virol. 78, 1160–1168 (2004).
[7] Chomont, N. et al. HIV reservoir size and persistence are driven by T cell survival and homeostatic proliferation. Nature Med. 15, 893–900 (2009).
[8] Zhu, T. et al. Evidence for human immunodeficiency virus type 1 replication in vivo in CD14+ monocytes and its potential role as a source of virus in patients on highly active antiretroviral therapy. J. Virol. 76, 707–716 (2002).
[9] Persaud, D. et al. Continued production of drug-sensitive human immunodeficiency virus type 1 in children on combination antiretroviral therapy who have undetectable viral loads. J. Virol. 78, 968–979 (2004).
[10] Shen, L. & Siliciano, R. F. Viral reservoirs, residual viremia, and the potential of highly active antiretroviral therapy to eradicate HIV infection. J. Allergy Clin. Immunol. 122, 22–28 (2008).
[11] Persaud, D. et al. A stable latent reservoir for HIV-1 in resting CD4+T lymphocytes in infected children. J. Clin. Invest. 105, 995–1003 (2000).
[12] Yukl, S. A. et al. The distribution of HIV DNA and RNA in cell subsets differs ingut and blood of HIV-positive patients on ART : implications for viral persistence. J. Infect. Dis. 208, 1212–1220 (2013).
[13] Fletcher, C. V. et al. Persistent HIV-1 replication is associated with lower antiretroviral drug concentrations in lymphatic tissues. Proc. Natl Acad. Sci. USA 111, 2307–2312 (2014).
[14] Günthard, H. F. et al. Evolution of envelope sequences of human immunodeficiency virus type 1 in cellular reservoirs in the setting of potent antiviral therapy. J. Virol. 73, 9404–9412 (1999).
[15] Kearney, M. F. et al. Lack of detectable HIV-1 molecular evolution during suppressive antiretroviral therapy. PLoS Pathog. 10, e1004010 (2014).
[16] Josefsson, L. et al. Majority of CD4+ T cells from peripheral blood of HIV-1-infected individuals contain only one HIV DNA molecule. Proc. Natl Acad. Sci. USA 108, 11199–11204 (2011).
[17] Wong, J. K. et al. In vivo compartmentalization of human immunodeficiency virus : evidence from the examination of pol sequences from autopsy tissues. J. Virol. 71, 2059–2071 (1997).
[18] von Andrian, U. H. & Mempel, T. R. Homing and cellular traffic in lymph nodes. Nature Rev. Immunol. 3, 867–878 (2003).
[19] Archer, J. et al. Analysis of high-depth sequence data for studying viraldiversity : a comparison of next generation sequencing platforms usingSegminator II. BMC Bioinformatics 13, 47 (2012).
[20] Kim, E. Y. et al. Human APOBEC3 induced mutation of human immunodeficiency virus type-1 contributes to adaptation and evolution in natural infection. PLoS Pathog. 10, e1004281 (2014).
[21] Lemey, P., Rambaut, A. & Pybus, O. G. HIV evolutionary dynamics within and among hosts. AIDS Rev. 8, 125–140 (2006).
[22] Frenkel, L. M. et al. Multiple viral genetic analyses detect low-level human immunodeficiency virus type 1 replication during effective highly active antiretroviral therapy. J. Virol. 77, 5721–5730 (2003).
[23] Nickle, D. C. et al. Evolutionary indicators of human immunodeficiency virus type 1 reservoirs and compartments. J. Virol. 77, 5540–5546 (2003).
[24] Murrell, B. et al. Gene-wide identification of episodic selection. Mol. Biol. Evol. (2015).
[25] Kryazhimskiy, S. & Plotkin, J. B. The population genetics of dN/dS. PLoS Genet. 4, e1000304 (2008).
[26] Mugal, C. F., Wolf, J. B. & Kaj, I. Why time matters : codon evolution and the temporal dynamics of dN/dS. Mol. Biol. Evol. 31, 212–231 (2014).
[27] Bouckaert, R. et al. BEAST 2 : a software platform for Bayesian evolutionary analysis. PLOS Comput. Biol. 10, e1003537 (2014).
[28] Lemey, P., Rambaut, A., Drummond, A. J. & Suchard, M. A. Bayesian phylogeography finds its roots. PLOS Comput. Biol. 5, e1000520 (2009).
[29] Vaughan, T. G., Kuhnert, D., Popinga, A., Welch, D. & Drummond, A. J. Efficient Bayesian inference under the structured coalescent. Bioinformatics 30,2272–2279 (2014).
[30] Frost, S. D. W. et al. Eight challenges in phylodynamic inference. Epidemics 10, 88–92 (2015).
[31] Tobin, N. H. et al. Evidence that low-level viremias during effective highly active antiretroviral therapy result from two processes : expression of archival virus and replication of virus. J. Virol. 79, 625–9634 (2005).
[32] Anderson, J. A. et al. Clonal sequences recovered from plasma from patients with residual HIV-1 viremia and on intensified antiretroviral therapy are identical to replicating viral RNAs recovered from circulating resting CD4+ T cells. J. Virol. 85, 5220–5223 (2011).
[33] Wagner, T. A. et al. Proliferation of cells with HIV integrated into cancer genes contributes to persistent infection. Science (2014).
[34] Maldarelli, F. et al. HIV latency. Specific HIV integration sites are linked to clonal expansion and persistence of infected cells. Science 345, 179–183 (2014).
[35] Althaus, C. L., Joos, B., Perelson, A. S. & Günthard, H. F. Quantifying the turnover of transcriptional subclasses of HIV-1-infected cells. PLOS Comput. Biol. 10, e1003871 (2014).
[36] Kepler, T. B. & Perelson, A. S. Drug concentration heterogeneity facilitates the evolution of drug resistance. Proc. Natl Acad. Sci. USA 95, 11514–11519 (1998).][[Rong, L., Dahari, H., Ribeiro, R. M. & Perelson, A. S. Rapid emergence of protease inhibitor resistance in hepatitis C virus. Sci. Transl. Med. 2, 30ra32 (2010).
[37] McLean, A. R. & Nowak, M. A. Competition between zidovudine-sensitive and zidovudine-resistant strains of HIV. AIDS 6, 71–79 (1992).
[38] Furtado, M. R. et al. Persistence of HIV-1 transcription in peripheral-blood mononuclear cells in patients receiving potent antiretroviral therapy. N. Engl. J. Med. 340, 1614–1622 (1999).
